V 21. století se kralování ve vědě ujala biologie. Převratné poznatky z genetiky postupně pronikají do medicíny a mění ji k nepoznání. Lékaři dokážou odhalit nemoc ještě předtím, než vypukne. Jsou schopni předvídat, jak se bude onemocnění vyvíjet, a připravit léčbu „na míru“ pro každého pacienta podle jeho genetické výbavy a stavu organizmu.
„Kdyby neexistovaly rozdíly mezi jednotlivými pacienty, medicína by byla jen vědou a nikdy ne uměním.“ Tento výrok se připisuje kanadskému lékaři Williamu Oslerovi, spoluzakladateli Nemocnice Johna Hopkinse, která vznikla v roce 1889 v americkém Baltimoru. „Poslouchejte svého pacienta, říká vám diagnózu,“ přizvukoval studentům medicíny, když je v rámci reformy vzdělávání posílal na klinickou praxi.
Síť sítí v biologii  Medicína i dnes „poslouchá svého pacienta“, i když už nevystačí jen s fonendoskopem. Zdraví nejednou závisí na mikroskopických detailech a lékaři jsou čím dál tím více odkázáni na technologie. Už nezkoumají jen „makrosvět“ tkání a orgánů, ale pouštějí se stále hlouběji do „mikrosvěta“ molekul a atomů. A stejně tak jako fyzika, která touží po „velké teorii všeho“, spojující relativistický svět s kvantovou mechanikou, také medicína hledá jednotu mezi chemií buněk a bezchybným fungováním celé tělesné schránky.
Medicína i dnes „poslouchá svého pacienta“, i když už nevystačí jen s fonendoskopem. Zdraví nejednou závisí na mikroskopických detailech a lékaři jsou čím dál tím více odkázáni na technologie. Už nezkoumají jen „makrosvět“ tkání a orgánů, ale pouštějí se stále hlouběji do „mikrosvěta“ molekul a atomů. A stejně tak jako fyzika, která touží po „velké teorii všeho“, spojující relativistický svět s kvantovou mechanikou, také medicína hledá jednotu mezi chemií buněk a bezchybným fungováním celé tělesné schránky.
O „teorii všeho“ pro živé organizmy se v závěru minulého století pokusil americký biolog Leroy Hood, působící tehdy na Washingtonské univerzitě.
Lidské tělo popsal jako ucelený biologický systém, jakousi „síť sítí“. Sítě na různých úrovních tvoří orgány, buňky, molekuly až po DNA. Pokud chceme pochopit celý systém, musíme jednotlivé sítě dokonale poznat
a zároveň zjistit, jak navzájem kooperují. Současně je třeba pochopit, jak se bude vlivem času či jiných faktorů interakce sítí měnit.
V obráceném gardu
Teorie systémů či optimalizace sítí jsou metody z informatiky. Jejich uplatnění v biologii není samoúčelné,
pro medicínu může mít revoluční význam. Umožňuje rozšířit a prohloubit přechod od reaktivního přístupu k preventivnímu.
Klasická medicína začíná léčbu po vypuknutí choroby. Diagnostika se zaměřuje na její klinické příznaky a symptomy, sleduje anamnézu pacienta, shromažďuje údaje z laboratoří, aby na jejich základě určila léčbu. Proaktivní přístup je opačný – pokud víme, jak funguje „síť sítí“, můžeme dopředu ladit jednotlivé prvky tak, aby celý systém pracoval bez problémů. A pokud se nějaký problém objeví, umíme cíleně zasáhnout a navíc
i předvídat, co tento zásah způsobí.
Medicína na míru
Jenže „biologické sítě“ jsou mimořádně složité a bylo by velkým překvapením, kdyby se sobě podobaly jako vejce vejci. I to je důvod, proč různí pacienti se stejnou diagnózou reagují na stejnou léčbu různým způsobem. Zatímco pro jednoho může být lék velkým dobrodiním, druhému nepomůže. Ke zjištění rozdílů už nestačí jen „umělecký talent“ lékaře či zkušenost a intuice Dr. Housea. Pokud chce medicína pomoci každému, bude čím dál tím víc odkázaná na vědu. „Klinický lékař se v posledních letech stává vykonavatelem standardních protokolů, které se pravidelně inovují podle nových zjištění. Prostor na lékařské úvahy a domněnky se výrazně zužuje. Lékaře to frustruje, pro pacienty to ale přináší jednoznačné benefity,“ potvrzuje Peter Celec, přednosta Ústavu molekulární biomedicíny LF UK a Molekulárně-medicínského centra SAV.
Na prvním místě je genetika, protože pořadí nukleotidů v DNA předurčuje schopnost buňky vyhnout se selháním anebo odolat útokům vetřelců. Dokáže určit míru rizika nebo jestli se nemoc rozvine. Farmagenomika zase hledá odpověď na otázku, jak organizmus zareaguje na léky a umožní nastavit optimální dávky. Lékař se neobejde ani bez molekulárně-biologických vyšetření, pátrajících po různých biomarkerech v krvi. Dokážou rozpoznat nemoc ještě před vypuknutím a přesně sledují reakci organizmu na léčbu.
Pacientům už slouží test, který rozezná specifickou formu viru HIV. Společný podnik GlaxoSmithKline a Pfizer – firma ViiV Healthcare – vyrábí lék Selzentry, schopný potlačit právě tento virus. |
Riziko odhalí jediná molekula
Čtyřicetiletou pacientku s leukémií čekala transplantace kmenových buněk. Ani po náročném zákroku její šance na přežití nepřevyšovala patnáct procent. Když vědci přečetli její genom, z mutací některých genů zjistili, že na tento typ rakoviny bude účinnější chemoterapie. Šanci na přežití zvýšila na sedmdesát procent a stav pacientky se skutečně zlepšuje.
Tento příklad ukazuje, jak se moderní medicína „personalizuje“ pro potřeby každého pacienta. Díky nové diagnostice identifikuje specifické biologické, především genetické markery. Na jejich základě určí léčbu vhodnou pro konkrétního pacienta a lékaři mohou připravit cílený plán dlouhodobé prevence.
Genetické příčiny nemoci dnes umíme postupně odhalit. Ale u většiny nemocí se jedná jen o rizika, ne o diagnózu anebo vyloučení choroby. Kromě malé skupiny kompletně genetických onemocnění má většina víceré a různé příčiny. Naštěstí tyto často umíme ovlivnit.
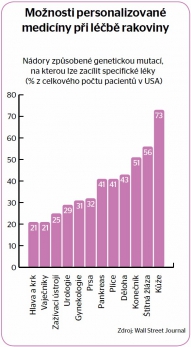
Nečekat na nemoc
Nejznámějším pacientem „nové medicíny“ je Angelina Jolieová. Podrobila se chirurgickému zákroku poté, co jí v genomu objevili nebezpečné mutace v genech BRCA1 a BRCA2. Pro 85 procent postižených žen znamenají celoživotní riziko rakoviny prsu a 60 procent ohrožuje rakovina vaječníků.
Bez velké publicity se v lékařských centrech přijímají desítky podobných rozhodnutí. Ne všechny příběhy však končí stejně takto šťastně. Odborná literatura popisuje případ pacientky, Angelininy vrstevnice, která na karcinom prsu a vaječníků zemřela. Lékaři automaticky označili za viníky geny BRCA1 a BRCA2, avšak genetické testy je vyvedly z omylu. Odhalily mutaci genu TP53, jehož úlohou je potlačovat tvorbu nádorů. Medicína tak může ochránit aspoň děti pacientky. I kdyby zhoubnou mutaci zdědily, díky pravidelnému screeningu existuje velká šance, že se podaří zachytit rakovinu už v počátečním, léčitelném stádiu.
Genetika je základ
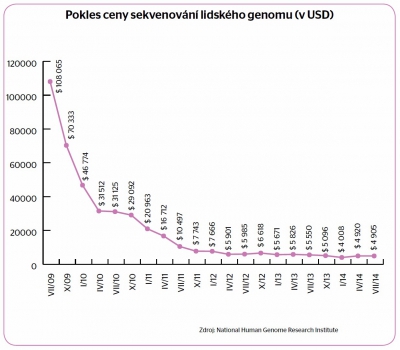
„Sekvencování genomu se stává důležitým diagnostickým nástrojem,“ říká Richard K. Wilson, ředitel Ústavu genetiky Washingtonské univerzity, který je lídrem ve výzkumu rakoviny. Existuje však vícero překážek, aby se molekulární diagnostika stala rutinní záležitostí. Na prvním místě je cena – sekvencování celého genomu vyjde na zhruba dvacet tisíc dolarů, a poněvadž v případě rakoviny je potřeba zkoumat zdravé i nádorové buňky, cena se zdvojnásobí. Některé metody už sice snížily náklady na tisíc dolarů, ale nesplňuji požadavky na přesnost, které vyžaduje lékařská diagnostika.
Pomalejší nástup sekvencování způsobuje, že vědci dnes nedokážou interpretovat většinu informací získaných z genomu. „Je potřeba ještě objasnit mnoho genetických mutací, které mohou souviset s rakovinou,“ upozorňuje onkolog Timothy Ley z Washingtonské univerzity. Situace se zlepší až tehdy, kdy bude k dispozici víc sekvencovaných genomů pro medicínu.
Prostor pro inovace  Pro úspěšnou léčbu není důležité jen pátrání po biomarkerech. Po určení diagnózy následuje účinná terapie a prevence. Cílem je, aby konkrétní pacient dostal lék v optimálních dávkách, které maximálně zvyšují šanci na uzdravení. Vzniká tak nový prostor pro inovace – vývoj léků nové generace i nových léčebných procedur. To všechno vyžaduje testy, které zjišťují účinky léků podle genetických predispozic pacienta. Průzkumná agentura TriMark Publications očekává jen ve Spojených státech zdvojnásobení ročních investic do biomedicíny na 5,5 miliardy dolarů v roce 2016.
Pro úspěšnou léčbu není důležité jen pátrání po biomarkerech. Po určení diagnózy následuje účinná terapie a prevence. Cílem je, aby konkrétní pacient dostal lék v optimálních dávkách, které maximálně zvyšují šanci na uzdravení. Vzniká tak nový prostor pro inovace – vývoj léků nové generace i nových léčebných procedur. To všechno vyžaduje testy, které zjišťují účinky léků podle genetických predispozic pacienta. Průzkumná agentura TriMark Publications očekává jen ve Spojených státech zdvojnásobení ročních investic do biomedicíny na 5,5 miliardy dolarů v roce 2016.
Farmaceutické firmy v dalších letech vytvořily aliance s výrobci diagnostických a laboratorních přístrojů. Zapojují se všichni rozhodující hráči a také společnost Siemens Healthcare Diagnostics se sídlem v Kalifornii navázala partnerství s největšími výrobci léčiv.
Pacientům už slouží test, který rozezná specifickou formu viru HIV. Společný podnik GlaxoSmithKline a Pfizer – firma ViiV Healthcare – vyrábí lék Selzentry, schopný potlačit právě tento virus. Díky testu dokážou lékaři určit, u kterých pacientů bude léčba efektivní. Další testy se připravují pro společnost Tocaden, která experimentuje s léčbou nádorů mozku, inovativní firma Janssen z korporace Johnson & Johnson zase podepsala se Siemens dohodu o vývoji diagnostických testů pro lék na léčbu selhání srdce.
Tlak na legislativu
V uplynulých dvou desetiletích vědci vyvinuli více než 300 nových způsobů léčby pro více než 150 onemocnění. Pro biomedicínu dnes existuje 102 léků, o kterých se ví, že jejich účinek výrazně závisí na genomu pacienta. Třetina z těchto léků je určena na léčbu různých forem rakoviny. Před třemi roky jsme to věděli jen o sedmdesáti.
Rychlejší přenos nových léčebných metod do klinické praxe je cílem Koalice pro personalizovanou medicínu ve Washingtonu. S více než 250 členy z řad vědců, inovátorů a firem, ale i zdravotnických a pacientských komunit je už pár let významným lobbistou, aby se proces schvalování nových postupů co nejvíc zjednodušil a urychlil.
P. Celec však upozorňuje, že i k personalizované medicíně jsou potřeba důkazy: „Každá personalizace musí projít klinickými zkouškami a to, samozřejmě, trvá, stejně tak jako u každého nového léku. Takže aplikace nejde tak rychle, jak by teoreticky bylo možné. Ale i vzhledem ke zkušenosti z minulosti medicíny je třeba počkat na důkazy – výsledky studií, a až potom podle nich měnit to, co dostává běžný pacient.“
Ľubomír Jurina